Baterai
Nikel-Cadmium (NiCd Battery)
Mohamad
Teguh Gumela
Baterai
merupakan salah satu media penyimpanan energi listrik yang telah digunakan
secara luas. Menurut cara pemakaiannya, baterai terbagi menjadi dua yakni disposable (satu kali pakai) dan rechargeable (dapat digunakan berulang
kali). Accumulator/Accu merupakan
salah satu contoh dari sumber daya rechargeable,
dan salah satu contoh rechargeable
battery adalah Baterai NiCd atau NiCad Battery. Baterai NiCd
menerapkan prinsip elektrokimia, di mana keberadaan zat elektrolit (zat yang
mampu menghantarkan listrik, umumnya zat ionik) dan dua elektroda, yang salah
satunya berperan sebagai kutub negatif sementara elektroda lain berperan
sebagai kutub positif, menyebabkan terjadinya siklus ionik yang menghasilkan
arus listrik. Baterai tersebut diberi nama NiCd karena menggunakan elektroda
Nikel dalam bentuk Nikel hidrat (NiOOH) dan Cadmium (Cd).
Nikel
sendiri merupakan logam berwarna putih-abu, dapat ditempa, elastis, serta
memiliki tingkat kekuatan dan resistansi terhadap korosi yang tinggi.
Resistansi tersebut sekaligus mengimplikasikan bahwa Nikel memiliki
kecenderungan yang relatif rendah untuk mengalami reduksi. Nikel juga merupakan
penghantar panas dan listrik yang cukup baik, serta memiliki sifat kemagnetan
pada suhu di bawah 345oC. Pada bentuk logam, Nikel tidak reaktif,
tidak larut dalam air panas maupun air dingin, ammonia, tidak terpengaruh oleh
asam nitrit yang terkonsentrasi, dan basa yang terkonsentrasi. Walau demikian,
Nikel larut dalam asam nitrit encer, sedikit larut dalam asam klorida encer, serta
asam sulfat encer.
Sementara
itu, logam Cadmium memilki warna putih-abu, dapat ditempa, elastis, dan
permukaannya memiliki rona kebiruan. Cadmium cukup lunak untuk dipotong dengan
menggunakan pisau, dapat larut dalam zat asam, tapi tidak dalam zat basa. Cadmium
memiliki banyak kesamaan dengan seng, tapi membentuk lebih banyak senyawa
kompleks.
Cadmium
memiliki energi potensial reduksi standar (Eored) sebesar
-0.40 V, sedangkan Eored Nikel sebesar -0.25 V (Daftar Eored
beberapa zat terlampir). Oleh karena Eored
Nikel lebih besar (lebih mendekati positif, yang berarti kecenderungan
mengalami reduksi lebih besar), maka dalam sistem baterai NiCd, yang
menggunakan Nikel dan Cadmium sebagai elektroda, elektroda Nikel akan mengalami
reduksi (di sebut sebagai katoda), sedangkan elektroda Cadmium mengalami
oksidasi (disebut sebagai anoda), selama reaksi spontan yang menghasilkan
listrik (discharge). Selanjutnya,
elektroda Nikel akan disebut sebagai elektroda positif, sementara elektroda
Cadmium disebut sebagai elektroda negatif. Reaksi kimia yang berlangsung di
dalam baterai NiCd melibatkan air dan zat elektrolit KOH, serta bersifat dapat
balik (reversible). Oleh karena itu,
baterai dapat ‘diisi ulang’ atau rechargeable,
dengan membalik reaksi yang semula mengubah energi kimia menjadi energi listrik,
kepada reaksi balikan yakni, mengubah energi listrik menjadi energi kimia. Pada
reaksi balikan, elektroda yang semula mengalami reduksi akan mengalami
oksidasi, begitupun sebaliknya untuk elektroda yang semua mengalami oksidasi
akan mengalami reduksi. Sehingga, katoda dan anoda berubah pada reaksi
kebalikan. Oleh karena itu, penggunaan istilah elektroda positif dan negatif
akan memudahkan pemahaman konsep, dari pada menggunakan istilah katoda dan
anoda pada mekanisme kerja baterai NiCd.
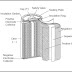
z Sebelum beranjak
lebih lanjut pada mekanisme reaksi kimia dalam baterai NiCd, perlu dipahami
terlebih dahulu struktur dan komponen pada baterai NiCd. Berikut ini adalah
penampang membujur baterai NiCd.
Gambar
1. Penampang Membujur Baterai NiCd (sumber : Nickel Cadmium Batteries: A Medium
for the Study of Metal Whiskers and Dendrites, 2006)
Seperti yang terlihat
pada Gambar 1, Komponen penyusun baterai NiCd adalah elektroda positif (Nikel
hidrat (NiOOH)), elektroda negatif (Cadmium), separator (berserat-serat/fibrous), case (sebagai pelindung
baterai), sealing plate (menjaga sistem
dari interferensi zat lain seperti CO2, yang dapat bereaksi dengan
2KOH membentuk K2CO3, dan menyebabkan terbentuknya CdCO3,
yang keduanya dapat mengganggu siklus dalam baterai), insulation ring, dan insulation
gasket.
Masih sesuai dengan
ilustrasi pada Gambar 1, kedua elektroda dalam baterai NiCd dipisahkan oleh
separator yang berserat dan memungkinkan gas untuk melaluinya. Menurut
pengamatan Anna Cyganowski pada baterai Sanyo Cadnica KR-1300 SC (1.2 V, 1300
mAh) berusia 10 tahun dengan menggunakan mikroskop optis Leitz perbesaran 3 hingga
25 kali, bahan penyusun separator adalah polypropylene/polyamine, seperti
nylon. Berikut adalah gambar baterai NiCd yang telah dibongkar.
Menurut literatur
dari Handbook of Secondary Storage
Batteries and Charge Regulators in Photovoltaic Systems, zat elektrolit
yang digunakan pada baterai NiCd adalah aqueous
KOH dengan konsentrasi 20-34% berat murni KOH. Tetapi, masih berdasarkan
pengamatan Anna Cyganowski pada baterai yang sama dengan alat yang sama, zat
elektrolit yang ada pada baterai teramati sebagai serbuk padat. Pada penjelasan
selanjutnya, keterangan literatur akan digunakan.
Selama penggunaan
baterai sebagai sumber energi listrik bagi berbagai alat elektronik, baterai
NiCd melakukan reaksi kimia. Adapun prinsip Elektrokimia yang bekerja adalah
bahwa pada baterai terjadi reaksi oksidasi dan reduksi yang menyebabkan
pergerakan elektron, sehingga dihasilkan arus listrik. Berikut ini adalah
reaksi kimia yang terjadi selama penggunaan baterai (discharge) :
Positif (reduksi) :
2NiOOH + 2H2O + 2e- --> 2Ni(OH)2 + 2OH-
Negatif (oksidasi) : Cd + 2OH- --> Cd(OH)2 + 2e-
reaksi net ion :
2NiOOH + 2H2O + Cd --> 2Ni(OH)2 + Cd(OH)2
Salah satu
karakteristik baterai NiCd adalah bahwa zat elektrolit tidak berperan secara
langsung, tapi berperan dalam transportasi OH-. Sementara itu,
apabila seluruh NiOOH telah diubah menjadi Ni(OH)2 dan atau seluruh
Cd telah menjadi Cd(OH)2 maka diperlukan 'pengisian ulang' baterai
agar ia dapat digunakan kembali. Hal tersebut dilakukan dengan membalik reaksi
melalui pemberian arus listrik (sesuai prinsip elektrolisis, mengubah energi
listrik menjadi energi kimia). Ketika arus listrik diberikan, maka elektron akan
bergerak menuju kutub baterai yang lebih positif dan menyebabkan reaksi kimia
kebalikan sebagai berikut :
Negatif (reduksi) :
Cd(OH)2 + 2e- --> Cd + 2OH-
Positif (oksidasi) : 2Ni(OH)2 + 2OH- --> 2NiOOH + 2H2O + 2e-
reaksi net ion :
2Ni(OH)2 + Cd(OH)2 --> 2NiOOH + 2H2O + Cd
Pengaliran arus
listrik memaksa terjadinya oksidasi-reduksi di dalam baterai, sehingga kondisi
kembali seperti sebelum digunakan. Tetapi, apabila terjadi overcharge (seluruh Ni(OH)2 dan atau Cd(OH)2
telah diubah menjadi NiOOH dan Cd tetapi arus listrik masih tetap dialirkan),
maka arus listrik akan tetap memaksa terjadinya oksidasi dan reduksi, dan
reaksi tersebut dilakukan pada air sesuai persamaan berikut :
Positif :
4OH- --> O2 + 2H2O + 4e-
Negatif :
2H2O + 4e- --> 2OH- + H2
net ion reaction : 2OH- --> H2 + O2
Tetapi, reaksi antara
oksigen dan hidrogen dapat menyebabkan ledakan dalam proses pembentukan air
dengan ∆E = -285.8 kJ/mol (∆E = perubahan entalpi, tabel entalpi pembentukan
beberapa zat terlampir). Oleh karena itu, gas harus dialirkan secara tepat,
atau pembentukan salah satu gas harus dicegah. Hal kedualah yang dilakukan para
pembuat baterai NiCd, yakni mencegah pembentukan gas Hidrogen. Untuk melakukan hal
tersebut, kapasitas elektroda negatif dibuat lebih besar dibandingkan elektroda
positif sehingga, elektroda positif akan 'terisi penuh' lebih dahlu dari elektroda
negatif.
Adapun reaksi kimia yang terjadi saat overcharging terjadi pada baterai NiCd
sesuai dengan penjelasan sebelunya adalah sebagai berikut :
Positif : 4OH- --> O2 + 2H2O
+ 4e-
Gambar 3. Perbandingan kapasitas Elektroda
Positif dan negatif (sumber : Harding
Battery Handbook For Quest®
Rechargeable Cells and Battery Packs )
Seperti
yang ditunjukkan persamaan sebelumnya, gas oksigen yang
dihasilkan elektroda positif kemudian diserap melalui reaksi dengan bagian elektroda negatif
yang belum terubah menjadi Cd(OH)2. Sehingga, ledakan yang
identik dengan api dan kerusakan dapat dihindari. Selama waktu tertentu, overcharging dapat diatasi melalui cara
tersebut, tetapi produksi gas Oksigen di
elektroda positif menghasilkan panas yang juga dapat merusak baterai. Jadi,
salah satu ciri-ciri overcharging
adalah baterai yang sudah memanas, apabila telah parah maka baterai bisa
menggelembung. Baterai NiCd sendiri
digunakan di berbagai alat elektronik seperti peralatan yang dikontrol remote, serta beberapa peralatan tanpa kabel yang lain. Kemampuan untuk 'diisi ulang' dan didaur
ulang, menjadi salah satu kelebihan baterai NiCd.
Apabila dibandingkan dengan baterai Lead-acid, NiCd menghasilkan arus
lebih tinggi dan bertahan lebih lama. Tetapi, NiCd menghasilkan arus yang lebih rendah dan memiliki masa
pakai yang lebih singkat dibandingkan dengan baterai Ni-Metal hydride dan Li-ion yang kini telah tersedia secara komersial dengan
harga lebih rendah. Terlebih
lagi, dua baterai tersebut lebih aman, karena diketahui Cadmium merupakan logam
berat beracun. Meski demikian, NiCd masih menjadi pilihan untuk menyediakan
arus stabil, sebab tidak seperti beberapa baterai lain, arus dari baterai NiCd
relatif stabil.
Perkembangan baterai NiCd terjadi secara bertahap. Sejak ditemukan pada tahun 1989 oleh
Waldemar Jugner, baterai NiCd mengalami beberapa perkembangan, di antaranya adalah penyegelan baterai
secara sempurna, dan pembentukan struktur ‘jelly-roll’ atau ‘sweden-roll’ pada baterai. Perkembangan tersebut
menunjukkan bahwa peran baterai NiCd cukup diperhitungkan untuk memenuhi berbagai kebutuhan energi listrik manusia.
Tetapi, elektroda Cd telah diketahui menyebabkan memory effect, di mana baterai
kehilangan daya lebih cepat dari yang diperkirakan. Pengamatan melalui scanning electron microscope (SEM) menunjukkan
bahwa terdapat perbedaan struktur elektroda negatif pada baterai sebelum pemakaian
dan setelah penggunaan dalam jangka panjang (gambar terlampir). Hal tersebut
terjadi karena terbentuknya kristal Cd dengan ukuran yang lebih besar pada
elektroda baterai setelah pengunaan, dibandingkan dengan elektroda pada baterai
ketika belum digunakan. Oleh karena itu, luas kontak elektroda dan zat
elektrolit menurun, sehingga total tegangan yang dihasilkan menurun pula.
Efek tersebut diakibatkan beberapa hal, tiga di
antaranya adalah ‘presentasi pengisian ulang baterai’ yang rendah, elektroda negatif
kekurangan zat pengembang (expander,
sejenis massa besi) yang dapat membantu mempertahankan struktur elektroda,
serta fase yang dialami elektroda negatif, yakni mengalami transisi sebagai
logam Cd dan sebagai Cd(OH)2. Transisi tersebut dapat memicu
pembentukan kristal apabila tidak terdapat expander.
Tetapi, hal utama yang menyebabkan pembentukan kristal adalah bahwa Cadmium
ternyata dapat membentuk senyawa intermetallic
dengan Ni yang banyak terdapat pada baterai NiCd jenis sintered plate (jenis baterai yang elektroda negatif maupun positifnya
dibuat dengan menuangkan gabungan partikel serbuk Ni, bukan lelehan, ke atas
lembaran material aktif yang kemudian secara kimiawi diresapi, sehingga
dihasilkan matriks dengan porositas lebih dari 80%). Senyawa tersebut di
antaranya adalah Ni2Cd5 dan Ni5Cd21.
Baterai NiCd jenis lain tidak membentuk senyawa tersebut.
Daftar Pustaka
Cyganowski, Anna. 2006.
Nickel Cadmium Batteries: A Medium for the
Study of Metal Whiskers and Dendrites. NASA Goddard, http://nepp.nasa.gov/whisker/dendrite/2006-cyganowski-paper.pdf
(diakses 23 Juni 2012).
Engineering Toolbox Team. Electrode
Potential and Galvanic Corrosion. http://www.engineeringtoolbox.com/electrode-potential-d_482.html
(diakses 20 Juni 2012).
Exide Management and Technology Company.1981.
Handbook of Secondary Storage Batteries and Charge Regulators in Photovoltaic
Systems. The U.S. Department of Energy Sandia National
Laboratories : New Mexico. http://www.azsolarcenter.org/tech-science/technical-papers/battery-handbook-for-pv-systems.html
(diunduh pada 22 Juni 2012).
Harding Energi Inc.
2004. Harding Battery Handbook. One
Energy Centre : Norton Shores, http://www.hardingenergy.com/index.php/handbook
(diunduh 22 Juni 2012).
Lancashire, Robert J.
2000.Nickel Chemistry. The Department of Chemistry, University of the West Indies, Mona
Campus, Kingston 7, Jamaica. http://wwwchem.uwimona.edu.jm/courses/nickel.html
(diakses 20 Juni 2012).
Lenntech Team. Cadmium Chemical Properties, Health
and Environmental Effects. http://www.lenntech.com/periodic/elements/cd.htm
(diakses 20 Juni 2012).
Matsushita Battery Industrial Co., Ltd. 1999. Nickel Cadmiun Batteries Technical Handbook : PDF File Technical
Handbook. http://www.master-instruments.com.au/Data%20Sheets/NiCd%20Industrial/Panasonic%20NiCd%20catalogue.pdf
(diunduh 22 Juni 2012).
McDowall, Jim. 2003. Memory
Effect in Stationary NiCd Batteries? Forget About It!. Saft
America Inc, http://www.battcon.com/PapersFinal2003/McDowallPaperFINAL2003.pdf
(paper diunduh 20 Juni 2012).
SPARKS,
<.C., 2010. The Batterys Role. Aircraft Maintenance Technology, 21(9),
pp. 20-20,22,24. http://search.proquest.com/docview/756966558?accountid=17242
(diunduh 20 Juni 2012).
Lampiran
Element
|
Electrode
Potential (Volts)
|
Lithium
|
-3.04
|
Rubidium
|
-2.92
|
Potassium
|
-2.92
|
Calcium
|
-2.87
|
Barium
|
-2.80
|
Sodium
|
-2.71
|
Magnesium
|
-2.37
|
Beryllium
|
-1.85
|
Aluminum
|
-1.67
|
Manganese
|
-1.19
|
Zinc
|
-0.76
|
Chromium
|
-0.74
|
Tungsten
|
-0.58
|
Iron
|
-0.44
|
Cadmium
|
-0.40
|
Cobalt
|
-0.28
|
Nickel
|
-0.24
|
Tin
|
-0.14
|
Lead
|
-0.13
|
Hydrogen
|
+0.00
|
Antimony
|
+0.10
|
Copper
|
+0.34
|
Iodine
|
+0.54
|
Silver
|
+0.80
|
Gold
|
+0.80
|
Mercury
|
+0.80
|
Iodide
|
+0.54
|
Bromine
|
+1.07
|
Platinum
|
+1.20
|
Chlorine
|
+1.36
|
Fluorine
|
+2.87
|
Lampiran 1., tabel energi potensial reduksi standar
beberapa zat (Sumber : http://www.engineeringtoolbox.com/electrode-potential-d_482.html)
Lampiran 2. Tabel Entalpi
Pembentukan Standar Beberapa Zat (sumber :
http://www.pvpusd.k12.ca.us/penhi/starodub/notes/unit4/5_notes.pdf)
Lampiran 3. Gambar hasil pengamatan
menggunakan SEM terhadap kristal elektroda negatif Baterai NiCd sebelum dan
setelah penggunaan dalam jangka panjang (sumber : Paper oleh Jim McDowall,
2003, Memory Effect in Stationary NiCd
Batteries? Forget About It!
)








0 komentar:
Posting Komentar