POTENSIOMETRI
POTENTIOMETRY
POTENTIOMETRY
Mohamad Teguh Gumelar
Apabila anda belum mempelajari pendahuluan kimia analitik, silahkan klik di sini.
Potentiometry is an analysis method which based on the potential measurement of an electrochemical cell. Potentiometry is widely used to detect the endpoint of titration, and frequently used to measure the concentration of ions in a solution which analyzed. Potentiometry itself constructed of some components as below :
If you have not read the introduction to analytical chemistry, you can read it here.
Potensiometri merupakan salah satu metode analisis dengan berdasar pada
pengukuran perbedaan tegangan dari sel elektrokimia. Potensiometri umum
digunakan untuk menentukan titik akhir titrasi, dan dewasa ini kerap
kali digunakan untuk mengukur konsentrasi ion dalam suatu larutan yang
dianalisis (analit). Potensiometri sendiri memiliki beberapa komponen
alat sebagai berikut :Potentiometry is an analysis method which based on the potential measurement of an electrochemical cell. Potentiometry is widely used to detect the endpoint of titration, and frequently used to measure the concentration of ions in a solution which analyzed. Potentiometry itself constructed of some components as below :
- Elektroda Pembanding (Reference electrode)
- Elektroda Indikator (Indicator electrode)
- Pengukur tegangan (Voltmeter)
- Larutan yang diuji (Analyzed solution)
- Jembatan Garam (Salt bridge)
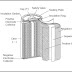
Gambar 1. Sel analisis potensiometri (sumber : Fundamentals of Analytical Chemistry, Skoog, Douglas A. et al)
Sebelum beranjak pada metode analisis potensiometri, yakni metode
langsung dan adisi, sebaiknya dipahami terlebih dahulu prinsip kerja
dari potensiometri. Seperti yang ditunjukkan gambar 1, bahwa pada sel
potensiometri terdapat dua elektroda, yakni elektroda pembanding dan
elektroda indikator. Perlu diingat, tujuan dari potensiometri yang akan
dibahas adalah untuk penentuan konsentrasi analit, sehingga keberadaan
dua elektroda tersebut tentu harus disangkutpautkan dengan konsentrasi
analit.
Before continue to potentiometric analytical method (direct and addition method), it is better to understand the working principle of Potentiometry. As shown in figure 1, that the potentiometric cell uses two electrodes, they are reference electrode and indicator electrode. Remember, the main purpose of potentiometry usually to measure the concentration of analyte (analyzed solution), hence the usage of those electrode must be somehow connected to the concentration.
Before continue to potentiometric analytical method (direct and addition method), it is better to understand the working principle of Potentiometry. As shown in figure 1, that the potentiometric cell uses two electrodes, they are reference electrode and indicator electrode. Remember, the main purpose of potentiometry usually to measure the concentration of analyte (analyzed solution), hence the usage of those electrode must be somehow connected to the concentration.
Elektroda pembanding adalah elektroda yang telah diketahui
potensial/tegangan dari setengah reaksi yang ia lakukan secara pasti.
Tegangan yang dihasilkan (Eref) konstan dan elektroda tidak peka terhadap larutan yang dipelajari. Contoh elektroda tersebut adalah kalomel (Hg2Cl2) dan perak (Ag). Contoh reaksi yang terjadi pada elektroda kalomel adalah sebagai berikut :
Reference electrode is an electrode with known half reaction potential/voltage. The potential (Eref) is constant and the electrode does not react with the analyte. Example of this electrode is calomel electrode (Hg2Cl2) and silver (Ag) electrode. Reaction which happening in the calomel electrode is as below :
Reference electrode is an electrode with known half reaction potential/voltage. The potential (Eref) is constant and the electrode does not react with the analyte. Example of this electrode is calomel electrode (Hg2Cl2) and silver (Ag) electrode. Reaction which happening in the calomel electrode is as below :
2e- + Hg2Cl2 --> 2Hg + 2Cl-………………………………..(1)
Sementara itu, elektroda indikator adalah elektroda yang bereaksi dengan analit dan tegangan yang dihasilkan (Eind)
bergantung pada konsentrasi analit. Melalui perbedaan potensial yang
ditemui, akan dapat ditentukan konsentrasi analit. Persamaan yang
menghubungkan kedua tegangan tersebut adalah sebagai berikut :
Meanwhile, indicator electrode is an electrode which react with the analyte and the potential produced (Eind) depends on the analyte concentration. Trough the difference of potential, the analyte concentration can be determined. The equation which connects both reference and indicator potential is as below :
Meanwhile, indicator electrode is an electrode which react with the analyte and the potential produced (Eind) depends on the analyte concentration. Trough the difference of potential, the analyte concentration can be determined. The equation which connects both reference and indicator potential is as below :
Esel = Eind - Eref + Ej……………………………………(2)
Esel diketahui melalui pengamatan terhadap voltmeter. Sementara itu, Ej adalah tegangan dari junction/sambungan
antara dua larutan elektrolit yang berbeda, dalam hal ini di ujung
jembatan garam, tempat teganan sambungan muncul (disebut juga tegangan
jungsi). Hal tersebut diilustrasikan pada gambar 2. Terlihat dua larutan
elektrolit berada dalam konsentrasi yang berebeda. Ketimpangan tersebut
menyebabkan molekul hidrogen dan Klor dari konsentrasi tinggi cenderung
untuk berdifusi menuju larutan dengan konsentrasi yang lebih rendah.
Akan tetapi, mobilitas kedua molekul tersebut berbeda, seperti yang
dianalogikan oleh panjang anak panah (mobilitas H+ lebih besar), sehingga ion H+
akan lebih banyak lolos dan meninggalkan elektrolit di sebelah kiri.
Lama kelamaan, elektrolit di kiri akan lebih negatif (karena kehilangan
ion H+ ), sementara elektrolit di kanan akan lebih positif (karena memperoleh ion H+). Perbedaan muatan tersebut menyebabkan beda potensial, yakni Ej.
Esel is known by observation on the voltmeter. Beside, Ej is a junction potential, potential which is caused by the charge difference between two different solution connected by the salt bridge. This is illustrated in figure 2. In figure 2 shown two solution with different concentration. The ions from the high concentration tend to move to the lower one. But, mobility of those ions are different (H+ mobility is higher), so by time the ion quantity will make a charge difference between those two solution (the left solution will be more negative because it lost many H+ ion and the right solution will be more positive). This difference in charge, causing junction potential.
Esel is known by observation on the voltmeter. Beside, Ej is a junction potential, potential which is caused by the charge difference between two different solution connected by the salt bridge. This is illustrated in figure 2. In figure 2 shown two solution with different concentration. The ions from the high concentration tend to move to the lower one. But, mobility of those ions are different (H+ mobility is higher), so by time the ion quantity will make a charge difference between those two solution (the left solution will be more negative because it lost many H+ ion and the right solution will be more positive). This difference in charge, causing junction potential.
Gambar 2. Ilustrasi sumber tegangan junction (Sumber : Fundamentals of Analytical Chemistry, Skoog, Douglas A. et al)
Pada gambar 1, letak proses tersebut terjadi adalah pada elektroda
pembanding yang dalam strukturnya memiliki dua larutan elektrolit dengan
salah satunya berfungsi sebagai jembatan garam, mencegah
bercampur/bereaksinya analit dan elektroda pembanding.
In figure 1, the charge transfers process happens at reference electrode, which had two electrolyte and one of them has function to prevent the occurrence of reaction between the electrode and the analyte.
In figure 1, the charge transfers process happens at reference electrode, which had two electrolyte and one of them has function to prevent the occurrence of reaction between the electrode and the analyte.
Gambar
3.Struktur salah satu elektroda pembanding (kalomel) (Sumber : :
Fundamentals of Analytical Chemistry, Skoog, Douglas A. et al)
Setelah Eref, Esel diketahui, maka Eind dapat diketahui (umumnya Ej diabaikan karena nilainya sangat kecil dan terminimalisir oleh jembatan garam), sehingga secara otomatis Eind yang mengandung informasi konsentrasi larutan dapat menjadi jalan untuk mengetahui nilai konsentrasi analit. Eind sendiri dapat ditentukan melalui persamaan berikut :
After Eref, Esel known, Eind can be determined (generally Ej is ignored because the value is small and minimized by salt bridge), hence automatically Eind which contains information about the analyte concentration, can open a way to get information about it. Eind itself can be calculated by the equation below :
After Eref, Esel known, Eind can be determined (generally Ej is ignored because the value is small and minimized by salt bridge), hence automatically Eind which contains information about the analyte concentration, can open a way to get information about it. Eind itself can be calculated by the equation below :
Keterangan/Legend :
EoXn+|X = Potensial standar (untuk elektroda indikator logam), konstan,
EoXn+|X = Pada persamaan Nernst dilambangkan L
EoXn+|X = Untuk elektroda membran merupakan jumlah beberapa konstanta.
aXn+ = Aktifitas spesies (pada larutan dapat disetarakan dengan konsentrasi Xn+)
pX = -log aXn+ (simbol lain untuk persamaan yang lain)
EoXn+|X = Standard Potential (for metal indicator electrode), constant,
EoXn+|X = In Nernst equation, it symbolized by L. Untuk elektroda membran,
EoXn+|X = For membrane electrode, it is a sum of some constants.
aXn+ = Species activity (in solution it can be equalized with concentration of Xn+)
aXn+ = Species activity (in solution it can be equalized with concentration of Xn+)
pX = -log aXn+ (equality, another symbol, used in another equation)
Maka,
melalui persamaan di atas konentrasi analit dapat dihitung. Begitulah
gambaran mekanisme kerja potensiometri. Terdapat 2 jenis elektroda
indikator yang dipakai dewasa ini, yakni jenis Logam dan jenis Membran.
Elektroda jenis membran terbagi lagi menjadi selektif molekul dan
selektif ion. Untuk jenis-jenis elektroda dijelaskan pada file yang
berbeda.
Based on the equation above, analyte concentration can be calculated. That is a small description about how potentiometry used in works. Nowadays, there are 2 kinds of indicator electrode, they are metal and membrane electrode. Membrane electrode divided into molecule selective electrode and ion selective electrode. Some kinds of electrode will be described in another post (coming soon).
Based on the equation above, analyte concentration can be calculated. That is a small description about how potentiometry used in works. Nowadays, there are 2 kinds of indicator electrode, they are metal and membrane electrode. Membrane electrode divided into molecule selective electrode and ion selective electrode. Some kinds of electrode will be described in another post (coming soon).
Selanjutnya, kita telah siap menuju metode analisis
potensiometri, yakni metode langsung dan adisi. Metode langsung
menyediakan cara yang cepat untuk menentukan aktivitas kation dan anion
dalam larutan analit. Metode ini membutuhkan pembandingan tegangan dari
sel dengan elektroda indikator di dalam larutan analit, terhadap
tegangan ketika elektroda tersebut dicelupkan ke dalam larutan yang
telah diketahui konsentrasinya secara tepat (larutan standar). Apabila
hasil tegangan yang diperoleh spesifik, tidakdiperlukan pemisahan
terlebih dahulu. Adapun beberapa persamaan yang digunakan dalam metode
potensiometri langsung adalah sebagai berikut : (pada penghitungan,
elektroda pembanding dianggap anoda, indikator dianggap katoda).
Now we are ready to jump to the potentiometric analysis method, direct method and addition method. Direct method gives a fast way to determine the cation and anion activity in analyte solution. This method needs a comparison of voltage between a cell (with indicator electrode in analyte solution), to a cell with indicator electrode in standard solution, the concentration of this solution is known. Some equation which can be used in this method are listed below : (In calculation, reference electrode is classified as anode, and the indicator electrode is classified as cathode).
Now we are ready to jump to the potentiometric analysis method, direct method and addition method. Direct method gives a fast way to determine the cation and anion activity in analyte solution. This method needs a comparison of voltage between a cell (with indicator electrode in analyte solution), to a cell with indicator electrode in standard solution, the concentration of this solution is known. Some equation which can be used in this method are listed below : (In calculation, reference electrode is classified as anode, and the indicator electrode is classified as cathode).
Esel = Eind - Eref + Ej --> Eind = Esel +Eref - Ej --> substitusi persamaan (3) diperoleh/By substituting equation (3) we can get :
Karena Ej, Eref, dan L merupakan konstanta, digabungkan menjadi konstanta K maka
[The equation is for cation] Because Ej, Eref, and L are constants, it can be grouped to K, so :
[The equation is for cation] Because Ej, Eref, and L are constants, it can be grouped to K, so :
Sementara itu, untuk anion An- maka persamaan menjadi :
Meanwhile, for calculation of anion An- the equation become :
Meanwhile, for calculation of anion An- the equation become :
Pada metode langsung, tahapan yang dilaksanakan adalah : Pertama,
mengukur respon instrumen dan menentukan nilai K. Setelah itu,
mensubstitusikan pX dengan -log[X] dengan [X] adalah konsentrasi zat X
dalam analit. Setelah itu, penghitungan dilakukan dan nilai [X] diketahui
sebagai konsentrasi analit.
In direct method, steps which done is : First, measuring response of instruments and determine K. After that, substituting pX with -log[X], where [X] means the concentration of substance X in analyte. Then, calculation done and [X] can be found.
Sementara itu pada metode kalibrasi, tahap pertama yang dilakukan adalah mempersiapkan deret standar, yakni sejumlah larutan standar (larutan yang mengandung zat yang diuji dalam berbagai konsentrasi yang diketahui, berbeda-beda untuk tiap zat yang diuji, dibuat dari pengenceran stock solution). Setelah itu, tegangan tiap larutan diukur dan diplot dengan sumbu y sebagai tegangan dan sumbu x sebagai konsentrasi larutan standar. Setelah kurva terbentuk, maka persamaan kurva y=mx+c akan digunakan untuk mengetahui konsentrasi sampel/analit yang telah diketahui tegangannya. Melalui substitusi nilai tegangan analit terhadap y, maka x (konsentrasi analit) akan diketahui.
Meanwhile in calibration method, the first step done is preparing a series of standard solution in different concentration. Standard solution is a solution which consists substances which are being analyzed in exact and known value (usually made by diluting stock solution). Then, potential of each solution measured and plotted. The x-axis used for the standard solution concentration, and the y-axis used for the potential/voltage measured. After the curve plotted, the curve equation defined as y=mx+c and will be used to calculate the analyte solution after measuring its potential. By substituting analyte potential to y, we can get x, the analyte concentration.
In direct method, steps which done is : First, measuring response of instruments and determine K. After that, substituting pX with -log[X], where [X] means the concentration of substance X in analyte. Then, calculation done and [X] can be found.
Sementara itu pada metode kalibrasi, tahap pertama yang dilakukan adalah mempersiapkan deret standar, yakni sejumlah larutan standar (larutan yang mengandung zat yang diuji dalam berbagai konsentrasi yang diketahui, berbeda-beda untuk tiap zat yang diuji, dibuat dari pengenceran stock solution). Setelah itu, tegangan tiap larutan diukur dan diplot dengan sumbu y sebagai tegangan dan sumbu x sebagai konsentrasi larutan standar. Setelah kurva terbentuk, maka persamaan kurva y=mx+c akan digunakan untuk mengetahui konsentrasi sampel/analit yang telah diketahui tegangannya. Melalui substitusi nilai tegangan analit terhadap y, maka x (konsentrasi analit) akan diketahui.
Meanwhile in calibration method, the first step done is preparing a series of standard solution in different concentration. Standard solution is a solution which consists substances which are being analyzed in exact and known value (usually made by diluting stock solution). Then, potential of each solution measured and plotted. The x-axis used for the standard solution concentration, and the y-axis used for the potential/voltage measured. After the curve plotted, the curve equation defined as y=mx+c and will be used to calculate the analyte solution after measuring its potential. By substituting analyte potential to y, we can get x, the analyte concentration.
Metode lain adalah metode adisi yang terbagi
menjadi dua jenis yakni, adisi standar dan adisi sampel. Metode adisi
standar digunakan pada analit dengan volume tertentu, yang belum
diketahui konsentrasinya. Metode ini dilakukan dengan mengukur potensial
elektroda sistem sebelum dan sesudah larutan standar, dalam volume yang
bervariasi, ditambahkan ke dalam analit/sampel, yang dianalisis.
Setelah itu, campuran-campuran diencerkan hingga mencapai volume yang
sama (volume total), sekaligus matriks yang sama, untuk kemudian dicari
nilai responnya dan konsentrasinya setelah pengenceran. Konsentrasi
kemudian diplot pada sumbu x dan respon instrumen (tegangan) pada sumbu y
untuk mengetahui konsentrasi sampel sebelum penambahan larutan standar.
Berikut ini adalah contoh dari tahapan tersebut:
Another method is addition method. This method is divided into standard addition and sample addition. The standard addition method used by mixing it to an analyte with specified volume, and unknown concentration. This method done by measuring the electrode potential before and after the analyte mixed with standards in various volume. After mixing the series of identical sample with standard solution in various volume, we dilute all of the solutions to a same volume. Then, the response in measured. The concentration then plotted. Y-axis is used to plot the response and the x-axis is used to plot the concentration of standard solution used. Here are a data example for those steps mentioned :
Another method is addition method. This method is divided into standard addition and sample addition. The standard addition method used by mixing it to an analyte with specified volume, and unknown concentration. This method done by measuring the electrode potential before and after the analyte mixed with standards in various volume. After mixing the series of identical sample with standard solution in various volume, we dilute all of the solutions to a same volume. Then, the response in measured. The concentration then plotted. Y-axis is used to plot the response and the x-axis is used to plot the concentration of standard solution used. Here are a data example for those steps mentioned :
tabel 1. Data respon standar dan analit (sumber : http://www.chem-is-try.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/metode-adisi-standar/)
table 1. Standard solution and analyte response data (source : http://www.chem-is-try.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/metode-adisi-standar/)
Gambar
4. Contoh kurva kalibrasi dalam metode adisi standar (sumber
:
http://www.chem-is-try.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/metode-adisi-standar/)
Image 4. Calibration curve in standard addition method (source : http://www.chem-is-try.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/metode-adisi-standar/)
Salah satu penggunaan metode adisi standar yang lain adalah pada gas chromatography,
untuk mengetahui substansi dalam analit yang belum diketahui. Selain
itu, metode adisi standar dapat mengatasi masalah ketidakakuratan data
konsentrasi dari kurva kalibrasi, seperti karena adanya faktor tertentu,
yang mempengaruhi rasio respon/konsentrasi, pada sampel, tetapi tidak
ada pada larutan standar, yang mana hal tersebut dapat menyebabkan
perubahan kemiringan kurva kalibrasi.
Standard addition method can handle inaccuracy of concentration data from calibration curve, because of some factor, that can affect the ratio of response/concentration in sample and then causing a change in calibration curve gradient.
Standard addition method can handle inaccuracy of concentration data from calibration curve, because of some factor, that can affect the ratio of response/concentration in sample and then causing a change in calibration curve gradient.
Sementara itu, metode adisi
sampel hampir serupa dengan metode adisi standar. Umumnya, metode ini
digunakan apabila sampel tersedia dalam jumlah sedikit, memiliki matriks
kompleks, atau berada dalam konsentrasi tinggi. Metode ini dilakukan
dengan menambahkan sampel pada larutan standar, sejenis dengan cara yang
dilaksanakan pada metode adisi standar.
Meanwhile, sample addition is only a bit different with standard addition. Generally, this method used while the sample available in a small quantity, has a complex matrix or in high concentration. This method done by adding sample to a standard solution, similar with standard addition.
Meanwhile, sample addition is only a bit different with standard addition. Generally, this method used while the sample available in a small quantity, has a complex matrix or in high concentration. This method done by adding sample to a standard solution, similar with standard addition.
Persamaan yang juga dapat digunakan dalam adisi standar adalah sebagai berikut :
Equations which can be used in standard addition is shown below :
Equations which can be used in standard addition is shown below :
respon analit (y) = kCanalit --> k= y/Canalit
respon campuran analit dan standar = kCcampuran
--> C = mol/volume, maka untuk konsentrasi campuran mol total adalah
mol dari larutan standar ditambah mol dari analit, dibagi volume total
atau Ccampuran = (CstdVstd + CanalitVanalit)/Vtotal
y = k(CanalitVanalit)/Vtotal + k(CstdVstd)/Vtotal
y = [(kVanalit)/Vtotal] Canalit + (k(CstdVstd)/Vtotal)
y = mx + b
sehingga x = Canalit = y – (k(CstdVstd)/Vtotal)/ [(kVanalit)/Vtotal] = CstdVstd/Vanalit
analyte response (y) = kCanalyte --> k= y/Canalyte
mixtire of standard and analyte response = kCmixture
--> C = mole/volume, hence for mixture concentration, the total mole is a summation of standard solution mole + analyte mole, divided by total volume, mathematically written as : Cmixture = (CstdVstd + CanalyteVanalyte)/Vtotal
y = k(CanalyteVanalyte)/Vtotal + k(CstdVstd)/Vtotal
y = [(kVanalyte)/Vtotal] Canalyte + (k(CstdVstd)/Vtotal)
y = mx + b
So, x = Canalyte = y – (k(CstdVstd)/Vtotal)/ [(kVanalyte)/Vtotal] = CstdVstd/Vanalyte
Pemicu
Fluorida merupakan zat kimia yang banyak digunakan dalam pasta gigi. Fluoride merupakan ion dari fluorine, yakni berupa F-.
Fluorida berfungsi memberikan efek deterjen dan membersihkan gigi,
tetapi ternyata fluoride dapat menyebabkan beberapa kerugian apabila
digunakan tidak sesuai dengan aturan (apa saja kerugiannya?). Anda dan kelompok anda diminta
untuk menganalisa kadar fluoride dari sebuah sampel pasta gigi.
Bagaimanakah anda merancang analisa tersebut? Pasta gigi seperti apa
yang aman untuk digunakan?
Trigger
Fluoride is a chemical substance which widely used in toothpaste. Fluoride is Fluoride in form of ion, F-. Fluoride play a role to give a detergent effect in toothpaste and to clean our teeth, but it can also gives some disadvantages if used without limitation (what are the disadvantages?). Your group is requested to analyze fluoride content in a toothpaste sample. How will you arrange the method to done that analysis?What kind of toothpaste is safe to be used?
Trigger
Fluoride is a chemical substance which widely used in toothpaste. Fluoride is Fluoride in form of ion, F-. Fluoride play a role to give a detergent effect in toothpaste and to clean our teeth, but it can also gives some disadvantages if used without limitation (what are the disadvantages?). Your group is requested to analyze fluoride content in a toothpaste sample. How will you arrange the method to done that analysis?What kind of toothpaste is safe to be used?
Selamat mengerjakan :)
Enjoy :)
Enjoy :)
Daftar Pustaka
Reference
Anonim. 2011. Standard Addition & Sample Addition methods for Ion Selective Electrodes. Nico 2000, http://www.nico2000.net/datasheets/staddl.html (diakses 27 Juni 2012).
Masykuri, M. 2009. Handout Kimia Analitik-4 : Potensiometri. http://masykuri.staff.fkip.uns.ac.id/files/2009/11/HandOut2-Potensiometri.pdf (diunduh 25 Juni 2012).
Skoog, Douglas A. 2004. Fundamentals of Analytical Chemistry. Canada : Thomson Learnng, Inc.
Wiryawan, Adam. 2011. Metode Adisi Standar.
http://www.chem-is-try.org/materi_kimia/instrumen_analisis/spektrofotometri-serapan-atom/metode-adisi-standar/
(diakses 27 Juni 2012).










terimakasih ya kak, membantu sekali :)
BalasHapus