Atomic Absorption Spectroscopy (AAS)
Mohamad Teguh Gumelar
Apabila anda belum tahu apa itu kimia analitik, silahkan baca di sini.
Apabila anda belum mengetahui apa itu spektroskopi, sebaiknya baca dulu pendahuluan spektroskopi di sini (klik).
If you haven't read/understand what analytical chemistry is, you can read it here.
If you haven't read/understand what spectroscopy is, you can read the introduction here.
Salah
satu metode analisa dengan menggunakan radiasi gelombang
elektromagnetik (GEM) adalah spektroskopi serapan atom (SSA). Interaksi
antara radiasi GEM dengan zat kimia yang ada dalam analit (zat yang
sedang dianalisa) menjadi kunci dalam SSA. Untuk memahami interaksi
tersebut, diperlukan postulat bahwa cahaya/radiasi GEM selain sebagai
gelombang, juga merupakan arus paket-paket energi yang disebut
foton/quanta. Dalam kata lain, cahaya memiliki dualisme sebagai gelombang dan materi.
One of some analytical method which utilize electromagnetic waves is atomic absorption spectroscopy (AAS). Interaction between the radiation and the substances within the analyte is the main key in AAS. To understand that interactions, we need a postulate that light/electromagnetic wave beside can be interpreted as a wave, also can be interpreted as a current of energy package called foton/quanta. In another word, light has a dualism, as a wave and as a material.
Ketika foton mendekati partikel dasar (atom, ion atau molekul) maka dapat terjadi absorpsi/penyerapan. Pada nomenklatur spektroskopik, absorpsi berarti proses di mana spesies kimia dalam medium transparan, secara selektif mengurangi intensitas dari radiasi elektromagnetik. Sesuai dengan teori kuantum, bahwa tiap partikel dasar memiliki tingkat energi tertentu, dengan tingkat paling rendah disebut ground state. Oleh karena itu, saat foton yang berlalu di dekat partikel dasar membawa jumlah energi yang tepat sama dengan selisih ground state terhadap tingkat energi berikutnya dari partikel tersebut, maka energi akan diserap partikel tersebut dan mengubah partikel ke tingkat energi yang lebih tinggi, disebut sebagai excitation state. Adapun gambaran pelaluan radiasi elektromagnetik pada sampel dapat dilihat pada gambar 1.
One of some analytical method which utilize electromagnetic waves is atomic absorption spectroscopy (AAS). Interaction between the radiation and the substances within the analyte is the main key in AAS. To understand that interactions, we need a postulate that light/electromagnetic wave beside can be interpreted as a wave, also can be interpreted as a current of energy package called foton/quanta. In another word, light has a dualism, as a wave and as a material.
Ketika foton mendekati partikel dasar (atom, ion atau molekul) maka dapat terjadi absorpsi/penyerapan. Pada nomenklatur spektroskopik, absorpsi berarti proses di mana spesies kimia dalam medium transparan, secara selektif mengurangi intensitas dari radiasi elektromagnetik. Sesuai dengan teori kuantum, bahwa tiap partikel dasar memiliki tingkat energi tertentu, dengan tingkat paling rendah disebut ground state. Oleh karena itu, saat foton yang berlalu di dekat partikel dasar membawa jumlah energi yang tepat sama dengan selisih ground state terhadap tingkat energi berikutnya dari partikel tersebut, maka energi akan diserap partikel tersebut dan mengubah partikel ke tingkat energi yang lebih tinggi, disebut sebagai excitation state. Adapun gambaran pelaluan radiasi elektromagnetik pada sampel dapat dilihat pada gambar 1.
While foton moves near an elementary particle (atoms, ion or molecule) absoprtion can be happened. In spectroscopic nomenclature, absroption means a process where chemical species in a transparent medium, selectively attenuates the radiation intensity from an electromagnetic radiation. Like the quantum theory said, every elementary particle has a specific energy state, with the lowest state called ground state. Therefore, while foton moves near the elementary particle and the foton contains energy which is equal with the energy difference (of an electron in a) ground state with the next energy state, the energy will be absorbed to excitate the electron from the ground state to the excitation state. Here the illustration of an electromagnetic radiation which is moves through an analyte.
Gambar 1. Ilustrasi Pelaksanaan Spektroskopi (Sumber : Sumber : Analytical Chemistry, Skoog, Douglas A dkk.)
Figure 1. Spectroscopy process illustration (sorurce : Analytical Chemistry, Skoog, Douglas A, et al)
Melalui
cara tersebut, maka daya (Power, P) dari radiasi elektromagnetik
setelah dilalukan pada sampel akan lebih kecil dibandingkan dengan daya
sebelum dilalukan, sehingga diperoleh dua persamaan sebagai berikut :
Trough that way, the Power (P) of electromagnetic radiation, after passing the sample, decreased (P after < P before --> P<Po). Then, scientists declare use some of these units in spectroscopy :
Trough that way, the Power (P) of electromagnetic radiation, after passing the sample, decreased (P after < P before --> P<Po). Then, scientists declare use some of these units in spectroscopy :
Transmittance, T = P/Po
Absorbance, A = log Po/P
Pada
ekseprimental, P merupakan daya setelah radiasi dilalukan melalui
sampel, dan Po merupakan daya radiasi ketika dilalukan melalui pelarut
saja. Pembandingan keduanya menghasilkan T dan melalui T dapat diperoleh
A. Berikut ini adalah contoh data keluaran dari instrumen berkenaan
dengan absorbansi dan transmittance :
In experimental means, Po is the Power of radiation which only pass the solvent, and P is the power of radiation that pass the sample.
In experimental means, Po is the Power of radiation which only pass the solvent, and P is the power of radiation that pass the sample.
Gambar 2. Data Penghitungan A dan T (sumber : Sumber : Analytical Chemistry, Skoog, Douglas A dkk.)
Data absorbansi dan informasi spectral lainnya dapat diplot membentuk kurva dalam beberapa cara sebagai berikut :
Absorbance data, spectral information can be served in a curve such as in the figure 2.
Absorbance data, spectral information can be served in a curve such as in the figure 2.
Gambar 3. Plot data spectral dengan ordinat Absorbansi dan absis panjang gelombang (Sumber : Analytical Chemistry, Skoog, Douglas A dkk.)
Selain seperti yang terlihat pada gambar 3, data dapat diplot dengan sumbu y sebagai transmittance ataupun log absorbance, sementara sumbu x tetap sebagai panjang gelombang.
Metode
Spektroskopi Atomik harus menggunakan sampel uji dalam keadaan sebagai
atom-atom. Menurut metode atomisasinya, spektroskopi atomik terbagi
menjadi beberapa jenis, salah satunya adalah flame atomization
(atomisasi dengan nyala api). Spektroskopi atomik dengan atomisasi nyala
sendiri terbagi kembali menjadi tiga jenis, yakni AAS (Atomic Absorption Spectroscopy), AES (Atomic Emission Spectroscopy) dan AFS (Atomic Fluorescence Spectroscopy). Selanjutnya akan dibahas mengenai AAS.
Beside as seen in figure 3, spectral data also can be presented by plotting transmittance or log absorbance in y-axis, and wavelength in x-axis. Atomic Spectroscopy have to use sample in atomic form. Based on it's atomization method, the atomic spectroscopy divided into some type, one of them is flame atomization atomic spectroscopy. This atomic spectroscopy itself divided again into three, they are atomic absorption spectroscopy, atomic emission spectroscopy and atomic fluorescence spectroscopy. In the rest of this post, we will discuss about the atomic absorption spectroscopy (AAS).
Beside as seen in figure 3, spectral data also can be presented by plotting transmittance or log absorbance in y-axis, and wavelength in x-axis. Atomic Spectroscopy have to use sample in atomic form. Based on it's atomization method, the atomic spectroscopy divided into some type, one of them is flame atomization atomic spectroscopy. This atomic spectroscopy itself divided again into three, they are atomic absorption spectroscopy, atomic emission spectroscopy and atomic fluorescence spectroscopy. In the rest of this post, we will discuss about the atomic absorption spectroscopy (AAS).
AAS
yang dalam Bahasa Indonesia disebut Spektrometri Serapan Atom (SSA),
merupakan metode analisa yang bertujuan untuk mengetahui informasi
konsentrasi suatu analit, sangat tepat untuk analit dalam konsentrasi
rendah. Seperti namanya, pada metode ini dilakukan penyerapan spektrum
cahaya tertentu oleh analit, yang kemudian data tersebut akan digunakan
untuk menentukan jenis unsur dalam analit sekaligus parameter lain yakni
absorbance dan transmittance. Besaran-besaran tersebut terhubung dengan Hukum Beer-Lambert yang dijelaskan melalui persamaan berikut:
AAS which in Bahasa called Spektrometri Serapan Atom (SSA), is an analysis method which to find out information about sample's concentration and good for sample in low concentration. In AAS, absorption of specific light spectrum happened, and then it used to determine the substance whitin the sample, absorbance and transimttance. Those units connected with Beer-Lambert law which can be desribed by the following equation :
AAS which in Bahasa called Spektrometri Serapan Atom (SSA), is an analysis method which to find out information about sample's concentration and good for sample in low concentration. In AAS, absorption of specific light spectrum happened, and then it used to determine the substance whitin the sample, absorbance and transimttance. Those units connected with Beer-Lambert law which can be desribed by the following equation :
A=abc…..(1)
Keterangan :
A = Absorbance
a = Absortivitas/absorptivity [Litre/gram cm]
b = Panjang lintasan yang dilalui radiasi elektromagnetik [cm]
Length of the path passed by the radiation
Length of the path passed by the radiation
c = Konsentrasi unsur dalam larutan analit [gram/Liter]
Concentration of substance in analyte solution
Concentration of substance in analyte solution
catatan : apabila c dalam mol/L dan b dalam cm maka a disimbolkan ɛ yakni absortivitas molar, dengan satuan Liter/mol cm.
notes : if c in mol/L and b in cm, then a symbolized by ɛ which is called molar absortivity, with units in Litre/mol cm.
notes : if c in mol/L and b in cm, then a symbolized by ɛ which is called molar absortivity, with units in Litre/mol cm.
Berikut ini adalah contoh data spektrum absorpsi atomik :
The following is an example of atomic spectral absorption data :
The following is an example of atomic spectral absorption data :
Gambar 4. Spektrum Absorpsi (Sumber : Analytical Chemistry, Skoog, Douglas A dkk.)
Pada
grafik terlihat absorbsi parsial dari radiasi elektromagnetik oleh uap
natrium. Energi yang yang diserap oleh atom natrium dijelaskan pada
gambar di samping kanan, di mana terlihat eksitasi dari tingkat energi
3s ke 5p. Pada grafik sebelah kanan panjang gelombang yang lebih pendek
memiliki energi yang lebih besar, begitupun ditunjukkan grafik sebelah
kanan bahwa eksitasi yang terjadi dengan menyerap energi di panjang
gelombang sekitar 285 nm lebih besar dibandingkan pada 330 nm dan 590
nm. Pernyataan tersebut dijelaskan oleh persamaan dari percobaan efek
fotolistrik yang pernah dilakukan Einstein sebagai berikut :
In the graphic, seen partial absorption of electromagnetic radiation by sodium vapour. The energy absorbed is described by the graphic in the right, and we can see that the wave with lower wavelength has a higher energy. This information supported by an equation form Einstein photoelectric experiment as follow :
In the graphic, seen partial absorption of electromagnetic radiation by sodium vapour. The energy absorbed is described by the graphic in the right, and we can see that the wave with lower wavelength has a higher energy. This information supported by an equation form Einstein photoelectric experiment as follow :
E=h.(c/λ)…..(2)
E = Energi foton/Photon energy c = Kecepatan Cahaya (3x108 m/s)/light speed
h = Konstanta Planck (6.6x10-34Js) λ = Panjang Gelombang/Wavelength
Pada
persamaan 2 di atas, terlihat bahwa tingkat energi foton berbanding
terbalik dengan panjang gelombangnya. Adapun contoh spektrum absorpsi
lain adalah sebagai berikut :

Gambar 5. Spektrum absorpsi (sumber : http://www.astro.princeton.edu/~dns/teachersguide/EveryDopAct.html)
Pada
gambar 5 terlihat ada beberapa spektrum yang menjadi garis hitam karena
diserap oleh atom-atom yang berada pada analit. Tiap unsur memiliki
spektrum yang unik sehingga metode AAS menjadi sangat selektif. Selain
itu, dibandingkan dengan metode lain, AAS membutuhkan biaya menengah,
tetapi cepat dalam proses pengolahannya. Adapun kesalahan dari limit
deteksi beberapa zat sekitar 1% hingga 2%, serta memiliki batas kadar
penentuan dari ppm (part per million) hingga ppb (part per billion).
Instrumen yang digunakan dalam SSA adalah sebagai berikut :
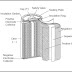
1. Lampu Katoda Berongga
Lampu
katoda adalah sumber radiasi yang digunakan. Lampu katoda spesifik
untuk unsur yang diuji. Misalnya pada lampu katoda Cu, maka lampu
tersebut hanya bisa digunakan untuk pengukuran unsur Cu saja. Lampu
katoda sendiri terbagi menjadi 2 jenis, yaitu lampu katoda monologam dan
multilogam.

Gambar 3. Lampu Katoda (sumber : http://gusnil45mind.wordpress.com)
Perbedaan dari kedua jenis lampu tersebut terletak pada kapasitas
pengukuran. Lampu jenis a hanya dapat digunakan untuk mengukur 1 jenis
unsur logam, sedangkan lampu jenis b dapat digunakan untuk mengukur
beberapa jenis unsur logam sekaligus. Bagian ujung lampu katoda yang
berwarna hitam berfungsi memudahkan pemasangan lampu katoda saat
dipasangkan ke dalam soket pada sistem SSA. Terdapat juga selotip yang
berfungsi untuk menutup semua ruangan dalam lampu sehingga, tidak ada
celah kosong yang memungkinkan masuknya gas dari luar, maupun
sebaliknya. Apabila hal tersebut terjadi, maka dapat menyebabkan
pencemaran pada lingkungan, dan keracunan bagi mahluk hidup di
lingkungan.
2. Tabung Gas
Tabung gas pada rangkaian alat ini adalah tabung gas yang berisi gas
asetilen. Selain itu terdapat pula tabung gas yang berisi gas N2O (Nitrous oxide).
Pada tabung gas asetilen, terdapat regulator yang berfungsi untuk
mengatur banyaknya gas yang akan dikeluarkan dan gas yang berada dalam
tabung.
Pendeteksian kebocoran pada tabung gas dapat dilakukan
dengan cara mendekatkan regulator tabung gas, yang diberi sedikit air,
kepada telinga. Apabila terdengar suara udara, berarti tabung gas
tersebut bocor. Sebaiknya, kontrol tabung gas tidak dilakukan dengan
penambahan minyak, sebab dapat menyebabkan penyumbatan tabung gas.
3. Atomizer
Alat ini terdiri dari Nebulizer, spray chamber, dan burner. Nebulizer
berfungsi untuk mengubah larutan menjadi aerosol, atau partikel butiran
halus, akibat efek aliran udara yang sesuai dengan hukum Bernouli.
Udara yang dialirkan adalah Oxidant yang digunakan (N2O). Kemudian sampel yang tercampur dengan Oxidant dicampur kembali dengan bahan bakar yang digunakan (Asetilen) di spray chamber.
Campuran lalu disemprotkan ke ruang pengabut, untuk membentuk aerosol
dengan ukuran 15-20 µm. Partikel tersebut kemudian bersama-sama dengan
aliran campuran gas bahan bakar, masuk ke dalam nyala api, sedangkan
titik-titik kabut yang besar dialirkan ke saluran pembuangan. Komponen
berkutnya adalah burner, yang merupakan komponen sistem, tempat terjadinya atomisasi, dengan menggunakan nyala api (flame).
4. Monokromator
Radiasi
yang disebabkan oleh eksitasi sampel akan menghasilkan energi yang
sebagian diserap dan sebagian lagi diteruskan. Fraksi radiasi yang
diteruskan dipisahkan dari radiasi lainnya. Pemisahan radiasi tersebut
dilakukan oleh monokromator. Lebih tepatnya, monokromator berfungsi
untuk memisahkan radiasi resonansi yang telah mengalami absorpsi, dari
radiasi yang lainnya. Radiasi lain yang dimaksud adalah radiasi yang
berasal dari lampu katoda berongga, gas pengisi lampu katoda berongga,
atau logam pengotor dalam lampu katoda berongga. Monokromator ini
sendiri tersiri atas sistem optik yaitu celah, cermin, dan kisi.
5. Detektor
Alat
ini berfungsi untuk mengukur radiasi yang telah ditransmisikan oleh
sampel, dan mengukur intensitas radiasi tersebut dalam bentuk energi
listrik. Detektor ini dibagi menjadi 2 macam, yaitu :
- Detektor Cahaya (Foton) : Detektor ini bekerja berdasarkan efek fotolistrik. Setiap foton akan membebaskan satu elektron dari bahan yang sensitif terhadap cahaya.
- Detektor Infra Merah (Panas) : Detektor ini berkerja berdasarkan timbulnya perbedaan temperatur dari efek termolistrik dua logam yang disambung menjadi satu.
Spektrofotometri
serapan atom (SSA/AAS) adalah suatu metode analisis yang didasarkan
pada proses penyerapan energi radiasi oleh atom-atom yang berada pada
tingkat energi dasar (ground state). Keunggulan metode AAS dibandingkan AES (link segera) dan AFS (link segera) adalah sebagai berikut:
- Spesifik,
- Batas (limit) deteksi rendah,
- Dari satu larutan yang sama, beberapa unsur berlainan dapat diukur,
- Pengukuran dapat langsung dilakukan terhadap larutan sampel,
- Dapat diaplikasikan pada banyak jenis unsur dalam berbagai jenis sampel,
- Batas kadar-kadar yang dapat ditentukan adalah amat luas (mg/L hingga persen).
Pada atomic absorptions
terdapat dua jenis interferensi, yakni interferensi spektral dan
kimiawi. Interferensi spektral terjadi karena adanya spektrum absorpsi
yang berdekatan, dengan jarak pemisah dalam hitungan 0.01 nm. Contohnya
adalah spektrum vanadium (308.211 nm) dan Alumunium (308.215 nm).
Tetapi, interferensi ini jarang terjadi. Interferensi spektral juga
dapat terjadi karena adanya pembakaran molekular yang menghasilkan
partkel penghambur radiasi. Sementara interferensi kimiawi terjadi
karena proses kimiwai selama atomisasi yang mempengaruhi karakteristik
absorpsi analit. Contohnya adalah interferensi dari silicon dalam
analisa kalsium.
Teknik analisis yang biasa digunakan adalah sebagai berikut :
1. Metode Standar Tunggal
Tidak
dianjurkan, sebab pada proses pembentukan uap atomik terdapat banyak
variabel yang tidak terkontrol, sehingga tidak bisa menjamin
penghitungan absorbansi. Umumnya dilakukan dua kali penghitungan.
Csampel/Asampel = Astandar/Cstandar -> Csampel = (Astandar x Asampel)/Cstandar
2. Kurva Kalibrasi
Metode
ini dilaksanakan dengan membuat deret larutan standar lalu mengukur
absorbansinya, setelah itu membuat kurva standar dan dengan Least Square
dan Regresi Linier, menentukan persamaannya. Setelah itu, absorbansi
sampel diukur dan diekstrapolasi ke dalam persamaan yang telah diperoleh
sebelumnya.
3. Adisi Standar
Metode ini digunakan secara
luas karena mampu meminimalisir kesalahan, seperti mencegah pembentuka
ion kompleks atau perubahan matriks. Persamaan yang berlaku :
Persamaan
3 di atas digunakan apabila analit yang digunakan terdiri atas 2, yakni
murni sampel dan campuran sampel-standar, dengan konsentrasi standar
yang diketahui. Metode adisi standar juga dapat dilaksanakan dengan
menggunakan beberapa analit, misal lima buah analit. Absorbansi kelima
analit kemudian diukur dan diplot membentuk kurva yang kemudian dicari
persamaannya dan dinyatakan sebagai y = mx + b. Pada kurva, sumbu X
adalah volume larutan standar dan sumbu Y adalah absorbansi. Oleh karena
itu, dari persamaan tadi diperoleh persamaan sebagai berikut :
y = Acampuran = (kCstdVstd+kCsampelVsampel)/Vtotal
y = kCstdVstd/Vtotal + kCsampelVsampel/Vtotal -> mx + b -> x = Vstd
diperoleh bahwa b/m = [kCsampelVsampel/Vtotal]/[ kCstd/Vtotal] = CsampelVsampel/Cstd
maka, Csampel = bCstd/mVsampel agar lebih mudah, maka sampel disimbolkan x dan standar disimbolkan s sehingga Cx = bCs/mVx.
Contoh langkah-langkah pelaksanaan adisi standar sesuai penjelasan di atas adalah sebagai berikut :
- Menyediakan 5 tabung erlen meyer dengan kapasitas masing-masing 50 mL.
- Menambahkan sampel limbah pelapisan logam dengan jumlah yang sama (Vu) sebanyak 25 mL ke semua tabung.
- Menambahkan larutan standar dengan jumlah 0 mL, 5 mL, 10 mL, 15 mL dan 20 mL dengan konsentrasi 20 ppm ke seluruh tabung secara berurutan.
- Melakukan pengenceran pada semua campuran hingga mencapai volume 50 mL dengan menggunakan air distilasi.
- Mengukur absorbansi seluruh campuran dengan menggunakan instrumen AAS.
- Membuat pemetaan dari absorbansi terhadap volume larutan standar yang ditambahkan pada kurva dua dimensi.
- Menentukan persamaan garis linear dar kurva yang telah dipetakan dengan menggunakan regresi linier dalam bentuk y = mx + b.
- Melakukan penghitungan konsentrasi sampel (Cx) dengan persamaan :
Cx = (bCs)/m(Vx)
9. Menghitung deviasi standar penghitungan.
Daftar Pustaka
Damarsasi, Dimas Gigih. Spektrometri Serapan Atom. 2010. Universitas Negri Semarang. http://www.scribd.com/doc/39329390/Makalah-AAS (diakses 5 Juli 2012).
Granger, Kara C. Activity : Everyday Doppler Shift. http://www.astro.princeton.edu/~dns/teachersguide/EveryDopAct.html (diakses 5 Juli 2012)
Skoog, Douglas A., West, Donald M., dan Holler, F.James. 1996. Analytical Chemistry. Saunders College Publishing : Amerika.
http://gusnil45mind.wordpress.com/2010/12/07/atomic-absorption-spektroscopy-aas/
catatan
: artikel ini dibuat berdasarkan hasil kerja kelompok saya dan
teman-teman saya yakni A.H.F adzima, Muthia Delaamira, Muthia PH, Stella
L. dan Tulus Setiawan.







0 komentar:
Posting Komentar